Déficits de synthèse des acides biliaires primaires
Les déficits de synthèse des acides biliaires primaires sont un groupe d’anomalies métaboliques génétiques dues à divers déficits enzymatiques intervenant dans la synthèse des acides biliaires primaires : l’acide cholique et l’acide chénodésoxycholique.1
Ce sont des maladies héréditaires autosomiques récessives rares qui peuvent se présenter sous la forme de cholestase néonatale, de maladie hépatique avancée, et/ou de malabsorption des graisses et des vitamines liposolubles.1,2
Les deux déficits responsables d’une maladie chronique du foie les plus fréquents sont :
- Le déficit en 3ß-hydroxy-C27-stéroïde oxydoréductase (3β-HSD)
- Le déficit en Δ4-3 oxostéroïde 5ß-réductase (Δ4-3-oxo-R)
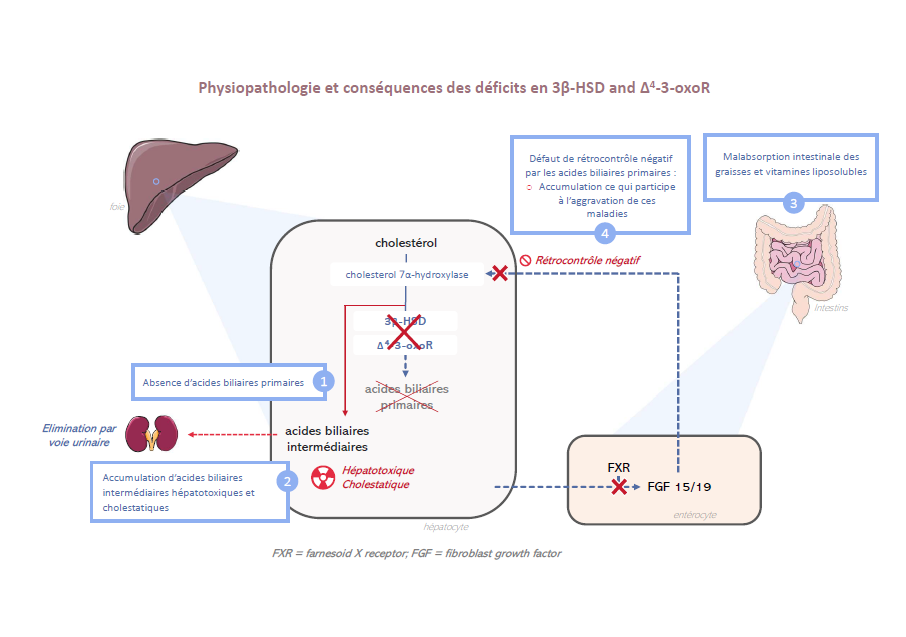
Ces déficits sont caractérisés par l’absence de production des acides biliaires primaires (acide cholique et acide chénodésoxycholique) et l’accumulation de métabolites intermédiaires atypiques des acides biliaires qui sont hépatotoxiques et cholestatiques.
En l’absence de traitement, ces déficits sont responsables d’une maladie chronique du foie évoluant vers la cirrhose et l’insuffisance hépatique, le plus souvent avant l’âge adulte.3
Les déficits de synthèse des acides biliaires représentent environ 1 % à 2 % des cholestases de l’enfant.
Des déficits en 3β-HSD et Δ4-3-oxo-R ont été rapportés dans toutes les régions du monde. Selon une enquête européenne récente, la prévalence minimale de ces deux affections serait de 1,13 pour 10 millions de personnes. Le déficit en Δ4-3-oxo-R est nettement plus rare que celui en 3β-HSD (prévalence estimée 0,14 pour 10 millions vs. 0,99 pour 10 millions).
La prévalence réelle est probablement supérieure, ces maladies étant sous-diagnostiquées.
(cliquez sur l’image pour l’afficher en plus grand)
Les déficits en 3β-HSD et Δ4–3-oxoR entraînent un blocage enzymatique dans la voie de biosynthèse des acides biliaires primaires. Par conséquent, les acides biliaires primaires ne sont pas synthétisés.
Cette absence diminue directement et fortement la sécrétion biliaire en réduisant la fraction de la sécrétion biliaire qui est dépendante des acides biliaires et entraîne une cholestase avec une activité gamma-glutamyl transférase (GGT) normale.
L’absence d’acides biliaires primaires dans l’intestin entraîne une malabsorption des graisses et des vitamines liposolubles (A, D, E et K).
En raison du bloc enzymatique, il y a une accumulation dans les hépatocytes d’intermédiaires des acides biliaires qui sont hépatotoxiques et cholestatiques.
Enfin, du fait de l’absence de synthèse d’acides biliaires primaires, il n’existe plus de rétrocontrôle négatif par les acides biliaires de la voie de synthèse des acides biliaires ce qui entraine une augmentation de la production des métabolites intermédiaires des acides biliaires. Ces métabolites ne peuvent pas être éliminés par la sécrétion biliaire qui est sidérée et sont éliminés par voie rénale. Leur concentration élevée dans les urines permet de les identifier et facilite le diagnostic (cf. Confirmation du diagnostic).
Le déficit en 3β-HSD doit être évoqué devant plusieurs tableaux cliniques évocateurs4:
- Un ictère cholestatique du nouveau-né ou une cholestase d’installation plus progressive du nourrisson ou du petit enfant ;
- Une pathologie (cholestatique) chronique du foie mal étiquetée, évoluant vers la cirrhose ;
- Un syndrome de malabsorption lipidique (stéatorrhée, sans pathologie digestive ou pancréatique) responsable de carences en vitamines liposolubles, symptomatiques ou pas :
- Manifestations hémorragiques du déficit en vitamine K
- Rachitisme ou hypocalcémie symptomatique du déficit en vitamine D
- Abolition des réflexes ostéotendineux et syndrome cérébelleux en rapport avec un déficit en vitamine E
- Manifestation ophtalmologique du déficit en vitamine A (kératite).
- Une absence de prurit ;
- Une hépatomégalie, voire une hépatosplénomégalie.
Ces signes peuvent survenir dans un contexte de consanguinité, voire d’antécédents d’hépatopathie chronique non identifiée dans la fratrie.
Le bilan biologique sanguin de routine montre :
- Une augmentation de la bilirubine conjuguée ;
- Une augmentation des transaminases ;
- Une activité gamma glutamyl-transférase (GGT) normale ;
- Et – fait capital – une concentration sérique normale des acides biliaires totaux, contrastant avec les signes cliniques de cholestase (selles décolorées, etc.).
La présentation clinique du déficit en Δ4–3-oxoR est similaire à celle du déficit en 3β-HSD, mais souvent plus précoce (premiers mois de vie). De plus, les nourrissons présentant un déficit en Δ4–3-oxoR ont tendance à avoir une maladie hépatique plus sévère avec une progression rapide vers la cirrhose et l’insuffisance hépatique.1
La confirmation du diagnostic repose sur des arguments biochimiques et génétiques.
L’analyse des acides biliaires urinaires en chromatographie gazeuse couplée à une spectrométrie de masse, ou une technique comparable (FAB-MS, LC-MS), est réalisée par des laboratoires spécialisés. Elle montre un profil d’excrétion urinaire spécifique de chaque type de déficit de synthèse des acides biliaires.
Dans le déficit en 3β-HSD et le déficit en Δ4–3-oxoR, l’étude métabolique des urines montre une excrétion élevée d’acides biliaires, cohérente avec la cholestase, mais qualitativement anormale :
- Absence ou traces d’acides biliaires primaires ;
- Présence de métabolites intermédiaires atypiques spécifiques de chaque déficit (3β-OH-Δ5 dans le déficit en 3β-HSD et 3-oxo-Δ4 dans le déficit en Δ4–3-oxoR).
Dans le déficit en Δ4–3-oxoR, l’étude des urines en spectrométrie de masse montre aussi la présence d’allo-acides biliaires. L’enzyme Δ4-3-oxo-R étant sensible à toute atteinte hépatique avancée, quelle qu’en soit la cause, un déficit génétique en Δ4-3-oxo-R est très probable si la proportion d’acides biliaires urinaires 3-oxo-Δ4 atteint ou dépasse 70 %.
Le diagnostic est ensuite confirmé par l’étude génétique en biologie moléculaire du gène HSD3B7 codant l’enzyme 3β-HSD ou du gène AKR1D1 codant l’enzyme Δ4-3-oxo-R.
Les déficits en 3β-HSD et Δ4-3-oxo-R sont caractérisés par une excellente réponse au traitement substitutif oral par un acide biliaire primaire administré à dose physiologique. Ce traitement doit être mis en route sans délai afin de prévenir une évolution défavorable de la maladie et d’éviter une transplantation hépatique.
Les effets pérennes et la bonne tolérance de ce traitement favorisent une bonne observance et permettent aux patients de mener une vie normale. Ces faits sont particulièrement importants, car l’administration doit être poursuivie à vie : en effet, si l’apport d’un acide biliaire primaire traite efficacement la maladie hépatique, il ne corrige pas le déficit enzymatique sous-jacent.
L’acide cholique (acide biliaire primaire majoritaire chez l’homme) fait l’objet d’une autorisation de mise sur le marché (AMM) en France (et en Europe) depuis 2013 (et aux États-Unis depuis 2015) pour le traitement des déficits en 3β-HSD et Δ4-3-oxo-R. Il constitue aujourd’hui le traitement de référence de ces maladies selon la plupart des experts et son utilisation bénéficie d’un recul important chez des enfants et des adultes.1,4
En effet, l’acide cholique restaure le rétrocontrôle physiologique de la synthèse des acides biliaires via l’activation du récepteur nucléaire FXR et l’inhibition de la cholestérol 7α-hydroxylase, enzyme limitante de la biosynthèse des acides biliaires. Il est aussi à l’origine d’une reprise de la sécrétion biliaire par l’hépatocyte.
Au cours de la prise en charge initiale du patient, notamment au diagnostic, une correction d’éventuelles carences en vitamines liposolubles (A, D, E, K) par voie orale, voire parentérale, peut être nécessaire.
Sources :
Ce résumé a été élaboré sur la base du Protocole National de Diagnostic et de Soins : Déficits de synthèse des acides biliaires primaires. Octobre 2019. Centre de référence de l’Atrésie des Voies Biliaires et des Cholestases Génétiques.
- Heubi, J. E., Setchell, K. D. R. & Bove, K. E. Inborn Errors of Bile Acid Metabolism. Clin Liver Dis 22, 671–687 (2018).
- Sundaram, S. S., Bove, K. E., Lovell, M. A. & Sokol, R. J. Mechanisms of disease: Inborn errors of bile acid synthesis. Nat Clin Pract Gastroenterol Hepatol 5, 456–468 (2008).
- Jahnel, J., Zöhrer, E., Fischler, B., D’Antiga, L., & al. Attempt to Determine the Prevalence of Two Inborn Errors of Primary Bile Acid Synthesis: Results of a European Survey. J. Pediatr. Gastroenterol. Nutr. 64, 864–868 (2017).
- Gonzales, E., Matarazzo, L., Franchi-Abella, S., Dabadie, A., & al. Cholic acid for primary bile acid synthesis defects: a life-saving therapy allowing a favorable outcome in adulthood. Orphanet J Rare Dis 13, 190 (2018).
Pour avoir des informations sur cette maladie, consultez :
![]() Fiche de l’encyclopédie professionnelle d’Orphanet
Fiche de l’encyclopédie professionnelle d’Orphanet
![]() Site de l’Association Maladies Foie Enfants (AMFE)
Site de l’Association Maladies Foie Enfants (AMFE)
![]() Vidéo du laboratoire Cell Therapies Research & Services (CTRS)
Vidéo du laboratoire Cell Therapies Research & Services (CTRS)
Cette maladie est prise en charge par le réseau Atrésie des Voies Biliaires et Cholestases Génétiques.